الکترون (e-یاβ-) ذره ای زیر اتمی با بار الکتریکی منفی یک بنیادی است. الکترونها به نسل اول خانواده ذرات لپتون تعلق دارند، و عموماً تصور میشود که ذرات بنیادی هستند زیرا هیچ مؤلفه یا زیرساخت شناختهشدهای ندارند. جرم الکترون تقریباً 1/1836 جرم پروتون است. خواص مکانیکی کوانتومی الکترون شامل یک تکانه زاویه ای ذاتی (اسپین) با یک مقدار نیم صحیح است که در واحدهای ثابت پلانک کاهش یافته، ħ بیان می شود. مطابق با اصل طرد پائولی، هیچ دو الکترونی نمی توانند حالت کوانتومی یکسانی را اشغال کنند. مانند همه ذرات بنیادی، الکترون ها هم خواص ذرات و هم امواج را از خود نشان می دهند: آنها می توانند با ذرات دیگر برخورد کنند و مانند نور می توانند پراش شوند. مشاهده خواص موجی الکترونها با آزمایشها آسانتر از سایر ذرات مانند نوترونها و پروتونها است، زیرا الکترونها جرم کمتری دارند و بنابراین طول موج دو بروگلی برای انرژی معین بیشتر است.
الکترون ها در بسیاری از پدیده های فیزیکی مانند الکتریسیته، مغناطیس، شیمی و هدایت حرارتی نقش اساسی دارند و در برهمکنش های گرانشی، الکترومغناطیسی و ضعیف نیز شرکت می کنند. از آنجایی که یک الکترون دارای بار است، میدان الکتریکی اطراف آن وجود دارد و اگر آن الکترون نسبت به یک ناظر در حال حرکت باشد، ناظر مذکور آن را مشاهده می کند تا میدان مغناطیسی ایجاد کند. میدان های الکترومغناطیسی تولید شده از منابع دیگر بر حرکت الکترون طبق قانون نیروی لورنتس تأثیر می گذارد. الکترون ها وقتی شتاب می گیرند انرژی را به شکل فوتون جذب می کنند. ابزارهای آزمایشگاهی قادر به به دام انداختن تک تک الکترون ها و همچنین پلاسمای الکترون با استفاده از میدان های الکترومغناطیسی هستند. تلسکوپ های ویژه می توانند پلاسمای الکترون را در فضای بیرونی شناسایی کنند. الکترون ها در بسیاری از کاربردها مانند تریبولوژی یا شارژ اصطکاکی، الکترولیز، الکتروشیمی، فناوری باتری، الکترونیک، جوشکاری، لوله های پرتو کاتدی، فوتوالکتریک، پنل های خورشیدی فتوولتائیک، میکروسکوپ های الکترونی، پرتودرمانی، لیزرها، آشکارسازهای یونیزاسیون گازی و شتاب دهنده های ذرات نقش دارند.
برهمکنش های شامل الکترون ها با دیگر ذرات زیراتمی در زمینه هایی مانند شیمی و فیزیک هسته ای مورد توجه است. برهمکنش نیروی کولن بین پروتون های مثبت درون هسته اتمی و الکترون های منفی بدون، امکان ترکیب این دو را که به عنوان اتم شناخته می شوند را فراهم می کند. یونیزاسیون یا تفاوت در نسبت الکترون های منفی در برابر هسته های مثبت، انرژی اتصال یک سیستم اتمی را تغییر می دهد. تبادل یا اشتراک الکترون ها بین دو یا چند اتم علت اصلی پیوند شیمیایی است. در سال 1838، فیلسوف طبیعی بریتانیایی ریچارد لمینگ برای اولین بار مفهوم مقدار غیرقابل تقسیم بار الکتریکی را برای توضیح خواص شیمیایی اتم ها فرض کرد. فیزیکدان ایرلندی جورج جانستون استونی در سال 1891 این بار را “الکترون” نامید و جی جی تامسون و تیم فیزیکدانان بریتانیایی او آن را به عنوان یک ذره در سال 1897 در طی آزمایش لوله پرتو کاتدی شناسایی کردند. الکترونها همچنین میتوانند در واکنشهای هستهای، مانند سنتز هستهای در ستارگان، که به عنوان ذرات بتا شناخته میشوند، شرکت کنند. الکترونها را میتوان از طریق واپاشی بتا ایزوتوپهای رادیواکتیو و در برخوردهای پرانرژی ایجاد کرد، برای مثال وقتی پرتوهای کیهانی وارد جو میشوند. پادذره الکترون پوزیترون نامیده می شود. با الکترون یکسان است با این تفاوت که حامل بار الکتریکی علامت مخالف است. هنگامی که یک الکترون با یک پوزیترون برخورد می کند، هر دو ذره می توانند نابود شوند و فوتون های پرتو گاما تولید کنند.
تاریخچه
کشف اثر نیروی الکتریکی
یونانیان باستان متوجه شدند که کهربا وقتی با خز مالیده می شود، اجسام کوچک را جذب می کند. همراه با رعد و برق، این پدیده یکی از اولین تجربیات ثبت شده بشر در مورد الکتریسیته است. دانشمند انگلیسی ویلیام گیلبرت در رساله 1600 خود De Magnete، اصطلاح لاتین جدید الکتریکی را ابداع کرد تا به موادی با خاصیت مشابه کهربا اشاره کند که اجسام کوچکتر را پس از مالش جذب می کنند. برق و الکتریسیته هر دو از کلمه لاتین ēlectrum (همچنین ریشه آلیاژی به همین نام) گرفته شده اند که از کلمه یونانی برای کهربا، ἤλεκτρον (ēlektron) گرفته شده است.
کشف دو نوع فرضیه
در اوایل دهه 1700، شیمیدان فرانسوی شارل فرانسوا دو فای دریافت که اگر یک ورق طلای باردار توسط شیشه ای که با ابریشم مالیده شده دفع شود، همان ورق طلای باردار توسط کهربایی که با پشم مالیده شده است جذب می شود. از این و سایر نتایج انواع آزمایشات مشابه، دو فای به این نتیجه رسید که الکتریسیته از دو سیال الکتریکی تشکیل شده است، مایع زجاجیه از شیشه ساییده شده با ابریشم و مایع رزینی از کهربا با پشم مالیده شده است. این دو مایع در صورت ترکیب می توانند یکدیگر را خنثی کنند. دانشمند آمریکایی ابنزر کینرسلی نیز بعداً به طور مستقل به همین نتیجه رسید. یک دهه بعد بنجامین فرانکلین پیشنهاد کرد که الکتریسیته از انواع مختلف سیال الکتریکی نیست، بلکه یک سیال الکتریکی منفرد است که بیش از حد (+) یا کسری (-) را نشان می دهد. . او نامگذاری بار مدرن را به ترتیب مثبت و منفی به آنها داد. فرانکلین حامل بار را مثبت میدانست، اما به درستی تشخیص نمیداد که کدام وضعیت مازاد حامل بار است و کدام وضعیت کسری است.
بین سالهای 1838 و 1851، فیلسوف طبیعی بریتانیایی ریچارد لمینگ این ایده را مطرح کرد که یک اتم از هسته ای از ماده تشکیل شده است که توسط ذرات زیر اتمی احاطه شده است که دارای بار الکتریکی واحد هستند. در آغاز سال 1846، فیزیکدان آلمانی ویلهلم ادوارد وبر این نظریه را مطرح کرد که الکتریسیته از سیالات دارای بار مثبت و منفی تشکیل شده است و برهمکنش آنها توسط قانون مربع معکوس کنترل می شود. پس از مطالعه پدیده الکترولیز در سال 1874، فیزیکدان ایرلندی جورج جانستون استونی پیشنهاد کرد که “یک مقدار معین الکتریسیته” وجود دارد که بار یک یون تک ظرفیتی است. او توانست مقدار این بار اولیه e را با استفاده از قوانین الکترولیز فارادی تخمین بزند. با این حال، استونی معتقد بود که این بارها به طور دائم به اتم ها متصل هستند و نمی توان آنها را حذف کرد. در سال 1881، هرمان فون هلمهولتز، فیزیکدان آلمانی، استدلال کرد که هر دو بار مثبت و منفی به بخش های ابتدایی تقسیم می شوند، که هر یک “مانند اتم های الکتریسیته رفتار می کنند”.
استونی در ابتدا واژه الکترولیون را در سال 1881 ابداع کرد. ده سال بعد، او برای توصیف این بارهای ابتدایی به الکترون روی آورد و در سال 1894 نوشت: “…تخمینی از مقدار واقعی این واحد اساسی الکتریسیته، قابل توجه ترین، انجام شد. من از آن زمان به این فکر افتادم که نام الکترون را پیشنهاد کنم. پیشنهاد سال 1906 برای تغییر به الکترون شکست خورد زیرا هندریک لورنتز ترجیح می داد الکترون را حفظ کند. واژه الکترون ترکیبی از دو واژه الکتریک و یون است. پسوند -on که اکنون برای تعیین ذرات زیراتمی دیگر، مانند پروتون یا نوترون استفاده می شود، به نوبه خود از الکترون مشتق شده است.
کشف الکترون های آزاد خارج از ماده
یک لوله خلاء شیشه ای گرد با یک پرتو دایره ای درخشان در داخل پرتوی از الکترون که توسط یک میدان مغناطیسی منحرف شده و به یک دایره منحرف می شود

جولیوس پلوکر، فیزیکدان آلمانی، در حین مطالعه هدایت الکتریکی در گازهای کمیاب در سال 1859، مشاهده کرد که تشعشعات ساطع شده از کاتد باعث می شود که نور فسفری روی دیواره لوله نزدیک کاتد ظاهر شود. و ناحیه نور فسفری می تواند با اعمال میدان مغناطیسی جابجا شود. در سال 1869، یوهان ویلهلم هیتورف، شاگرد پلوکر، دریافت که جسم جامدی که بین کاتد و فسفرسانس قرار می گیرد، بر ناحیه فسفری لوله سایه می اندازد. هیتورف استنباط کرد که پرتوهای مستقیمی از کاتد ساطع میشوند و فسفرسانس ناشی از برخورد پرتوها به دیوارههای لوله است. در سال 1876، فیزیکدان آلمانی یوگن گلدشتاین نشان داد که پرتوها عمود بر سطح کاتد گسیل می شوند که بین پرتوهای ساطع شده از کاتد و نور رشته ای تمایز قائل می شود. گلدشتاین پرتوها را پرتوهای کاتدی نامید. دههها تحقیق تجربی و نظری شامل پرتوهای کاتدی در کشف نهایی الکترونها توسط J. J. Thomson مهم بود.
در طول دهه 1870، شیمیدان و فیزیکدان انگلیسی سر ویلیام کروکس اولین لوله اشعه کاتدی را ایجاد کرد که خلاء بالایی در داخل داشت. او سپس در سال 1874 نشان داد که پرتوهای کاتدی وقتی در مسیر خود قرار می گیرند می توانند یک چرخ دست و پا زدن کوچک را بچرخانند. بنابراین، او نتیجه گرفت که پرتوها حرکت حرکتی دارند. علاوه بر این، با اعمال یک میدان مغناطیسی، او توانست پرتوها را منحرف کند، در نتیجه نشان داد که پرتو به گونهای رفتار میکند که گویی بار منفی دارد. در سال 1879، او پیشنهاد کرد که این ویژگیها را میتوان با در نظر گرفتن پرتوهای کاتدی بهعنوان متشکل از مولکولهای گازی با بار منفی در حالت چهارم ماده که در آن میانگین مسیر آزاد ذرات آنقدر طولانی است که ممکن است برخورد نادیده گرفته شود، توضیح داد.
فیزیکدان بریتانیایی آلمانی الاصل، آرتور شوستر، آزمایش های کروکس را با قرار دادن صفحات فلزی موازی با پرتوهای کاتدی و اعمال پتانسیل الکتریکی بین صفحات گسترش داد. میدان، پرتوها را به سمت صفحه دارای بار مثبت منحرف کرد و شواهد بیشتری را ارائه کرد که نشان میدهد پرتوها بار منفی دارند. شوستر با اندازهگیری مقدار انحراف برای یک سطح مشخص از جریان، در سال 1890 توانست نسبت بار به جرم اجزای پرتو را تخمین بزند. با این حال، این ارزشی بیش از هزار برابر بیشتر از آنچه انتظار میرفت تولید کرد، بنابراین در آن زمان اعتبار کمی به محاسبات او داده شد. این به این دلیل است که فرض بر این بود که حاملهای بار اتمهای هیدروژن یا نیتروژن بسیار سنگینتر هستند. تخمین های شوستر متعاقباً تا حد زیادی درست از آب در می آید.
در سال 1892 هندریک لورنتز پیشنهاد کرد که جرم این ذرات (الکترون ها) می تواند نتیجه بار الکتریکی آنها باشد.
جی جی تامسون هانری بکرل فیزیکدان فرانسوی در سال 1896 در حین مطالعه کانی های فلورسنت طبیعی متوجه شد که آنها بدون قرار گرفتن در معرض منبع انرژی خارجی تشعشع می کنند. این مواد رادیواکتیو موضوع مورد توجه بسیاری از دانشمندان، از جمله فیزیکدان نیوزیلندی، ارنست رادرفورد، که کشف کرد آنها ذرات را ساطع می کنند، شد. او این ذرات آلفا و بتا را بر اساس توانایی آنها در نفوذ در ماده تعیین کرد. در سال 1900، بکرل نشان داد که پرتوهای بتا ساطع شده توسط رادیوم می توانند توسط یک میدان الکتریکی منحرف شوند و نسبت جرم به بار آنها مانند پرتوهای کاتدی است. این شواهد این دیدگاه را تقویت کرد که الکترون ها به عنوان اجزای اتم وجود دارند.
در سال 1897، فیزیکدان بریتانیایی J. J. Thomson، به همراه همکارانش John S. Townsend و H. A. Wilson، آزمایشهایی را انجام دادند که نشان میداد پرتوهای کاتدی واقعاً ذرات منحصربهفرد هستند، نه امواج، اتمها یا مولکولهایی که قبلاً تصور میشد. تامسون تخمینهای خوبی از بار e و جرم m انجام داد و دریافت که ذرات پرتو کاتدی که او آنها را «هیدروژن» مینامید، احتمالاً یک هزارم جرم کم جرمترین یون شناختهشده: هیدروژن را دارند. او نشان داد که نسبت بار به جرم آنها، e/m، مستقل از ماده کاتد است. او همچنین نشان داد که ذرات باردار منفی تولید شده توسط مواد رادیواکتیو، مواد گرم شده و مواد روشن، جهانی هستند. نام الکترون برای این ذرات توسط جامعه علمی، عمدتاً به دلیل حمایت G. F. FitzGerald، J. Larmor، و H. A. Lorentz، انتخاب شد. تامسون متعاقباً در سال 1899 تخمینهایی را برای بار و جرم الکترون نیز ارائه داد: e~6.8×10-10 esu و m~3×10-26 g[43][44]
رابرت میلیکان بار الکترون توسط فیزیکدانان آمریکایی رابرت میلیکان و هاروی فلچر در آزمایش قطره روغن با دقت بیشتری اندازه گیری شد.
نظریه اتمی
سه دایره متحدالمرکز در اطراف یک هسته، با یک الکترون که از دایره دوم به دایره اول حرکت می کند و یک فوتون آزاد می کند.
مدل بور اتم، نشان دادن حالات یک الکترون با انرژی کوانتیزه شده با عدد n. الکترونی که به مدار پایینتری میافتد، فوتونی برابر با اختلاف انرژی بین مدارها منتشر میکند.
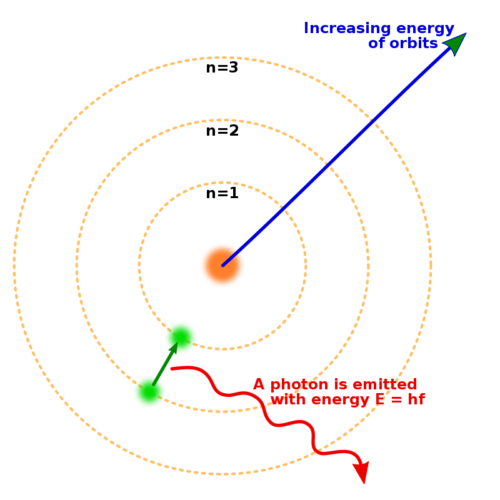
در سال 1914، آزمایشهایی که توسط فیزیکدانان ارنست رادرفورد، هنری موزلی، جیمز فرانک و گوستاو هرتز انجام شد، ساختار یک اتم را بهعنوان هستهای متراکم از بار مثبت که توسط الکترونهایی با جرم کمتر احاطه شده است، بهطور گسترده نشان داد. در سال 1913، نیلز بور، فیزیکدان دانمارکی، فرض کرد که الکترونها در حالتهای انرژی کوانتیزه قرار دارند و انرژیهایشان توسط تکانه زاویهای مدار الکترون به دور هسته تعیین میشود. الکترونها میتوانند با گسیل یا جذب فوتونهایی با فرکانسهای خاص، بین آن حالتها یا مدارها حرکت کنند. او با استفاده از این مدارهای کوانتیزه شده، خطوط طیفی اتم هیدروژن را به دقت توضیح داد. با این حال، مدل بور در توضیح شدت نسبی خطوط طیفی شکست خورد و در توضیح طیف اتمهای پیچیدهتر ناموفق بود.
پیوندهای شیمیایی بین اتم ها توسط گیلبرت نیوتن لوئیس توضیح داده شد که در سال 1916 پیشنهاد کرد که یک پیوند کووالانسی بین دو اتم توسط یک جفت الکترون مشترک بین آنها حفظ می شود. بعدها، در سال 1927، والتر هایتلر و فریتز لندن توضیح کاملی از تشکیل جفت الکترون و پیوند شیمیایی از نظر مکانیک کوانتومی ارائه کردند.[51] در سال 1919، شیمیدان آمریکایی، ایروینگ لانگمویر، مدل استاتیک اتم لوئیس را توضیح داد و پیشنهاد کرد که همه الکترونها در پوستههای کروی متحدالمرکز (تقریباً) متوالی با ضخامت یکسان توزیع شدهاند. او به نوبه خود، پوسته ها را به تعدادی سلول تقسیم کرد که هر کدام حاوی یک جفت الکترون بود. با این مدل، لانگمویر توانست خصوصیات شیمیایی همه عناصر جدول تناوبی را به صورت کیفی توضیح دهد، که مشخص بود طبق قانون تناوبی تا حد زیادی خود را تکرار می کنند.
در سال 1924، فیزیکدان اتریشی ولفگانگ پاولی مشاهده کرد که ساختار پوستهمانند اتم را میتوان با مجموعهای از چهار پارامتر که هر حالت انرژی کوانتومی را تعریف میکرد، توضیح داد، تا زمانی که هر حالت بیش از یک الکترون اشغال نشده باشد. این ممنوعیت در برابر بیش از یک الکترون که حالت انرژی کوانتومی یکسانی را اشغال می کند به عنوان اصل طرد پائولی شناخته شد. مکانیسم فیزیکی برای توضیح پارامتر چهارم، که دارای دو مقدار ممکن متمایز بود، توسط فیزیکدانان هلندی ساموئل گودسمیت و جورج اوهلنبک ارائه شد. در سال 1925، آنها پیشنهاد کردند که یک الکترون، علاوه بر تکانه زاویه ای مدارش، دارای یک تکانه زاویه ای ذاتی و گشتاور دوقطبی مغناطیسی است. این شبیه به چرخش زمین حول محور خود در حین گردش به دور خورشید است. تکانه زاویه ای ذاتی به عنوان اسپین شناخته شد و شکاف مرموز خطوط طیفی مشاهده شده با یک طیف نگار با وضوح بالا را توضیح داد. این پدیده به شکافتن ساختار ظریف معروف است.
مکانیک کوانتومی
در پایان نامه خود در سال 1924 Recherches sur la théorie des quanta (تحقیق در مورد نظریه کوانتومی)، فیزیکدان فرانسوی لوئیس دو بروگلی این فرضیه را مطرح کرد که همه مواد را می توان به عنوان یک موج دو بروگلی به شیوه نور نشان داد. یعنی در شرایط مناسب، الکترونها و سایر مواد خواص ذرات یا امواج را نشان میدهند. ویژگیهای جسمی یک ذره زمانی نشان داده میشود که نشان داده شود در هر لحظه موقعیت مکانی در فضا در امتداد مسیر خود دارد. ماهیت موج مانند نور نمایش داده می شود، به عنوان مثال، هنگامی که یک پرتو نور از شکاف های موازی عبور می کند و در نتیجه الگوهای تداخل ایجاد می کند. در سال 1927، جورج پاجت تامسون کشف کرد که اثر تداخل زمانی ایجاد میشود که پرتوی از الکترونها از میان ورقههای فلزی نازک و توسط فیزیکدانان آمریکایی کلینتون دیویسون و لستر گرمر توسط انعکاس الکترونها از کریستال نیکل عبور داده میشود.
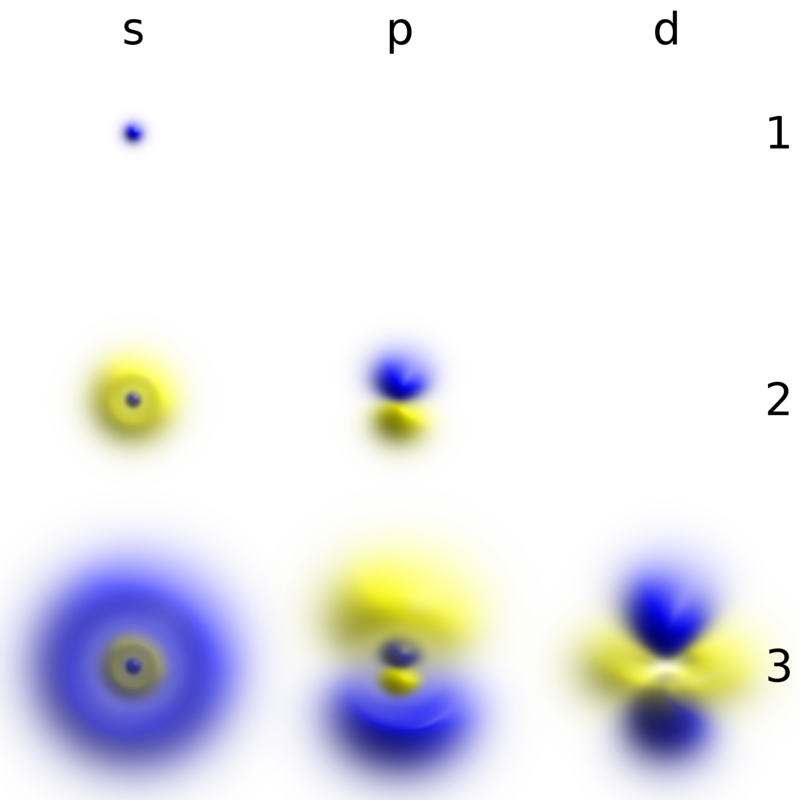
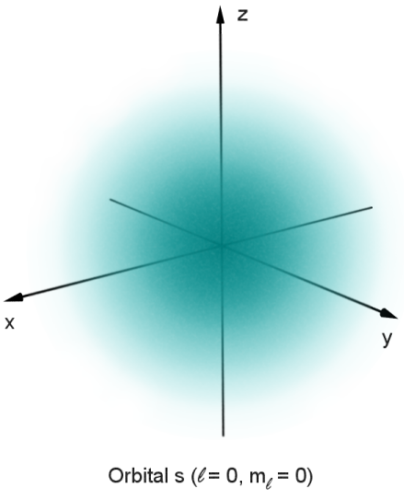
ابر آبی متقارن کروی که شدت آن از مرکز به بیرون کاهش می یابد
در مکانیک کوانتومی، رفتار یک الکترون در یک اتم توسط یک اوربیتال توصیف میشود که به جای یک مدار، توزیع احتمال است. در شکل، سایه احتمال نسبی یافتن الکترون را نشان می دهد که انرژی مربوط به اعداد کوانتومی داده شده را در آن نقطه دارد.
پیشبینی دی بروگلی در مورد ماهیت موجی برای الکترونها، اروین شرودینگر را بر آن داشت تا معادله موجی را برای الکترونهایی که تحت تأثیر هسته در اتم حرکت میکنند، فرض کند. در سال 1926، این معادله، معادله شرودینگر، نحوه انتشار امواج الکترونی را با موفقیت توصیف کرد. به جای ارائه راه حلی که مکان الکترون را در طول زمان تعیین می کند، این معادله موجی همچنین می تواند برای پیش بینی احتمال یافتن یک الکترون در نزدیکی یک موقعیت، به ویژه موقعیتی نزدیک به جایی که الکترون در فضا محدود شده است، استفاده شود. معادلات موج در زمان تغییر نکردند. این رویکرد منجر به فرمول دوم مکانیک کوانتومی شد (اولین فرمول توسط هایزنبرگ در سال 1925)، و راه حل های معادله شرودینگر، مانند هایزنبرگ، مشتقاتی از حالات انرژی یک الکترون در اتم هیدروژن ارائه کرد که معادل آنهایی بود که مشتق شده بود. اولین بار توسط بور در سال 1913، و به عنوان بازتولید طیف هیدروژن شناخته شده بود. هنگامی که اسپین و برهمکنش بین چندین الکترون قابل توصیف بود، مکانیک کوانتومی امکان پیشبینی پیکربندی الکترونها را در اتمهایی با عدد اتمی بیشتر از هیدروژن فراهم کرد.
در سال 1928، با تکیه بر کار ولفگانگ پائولی، پل دیراک مدلی از الکترون – معادله دیراک، مطابق با نظریه نسبیت را با اعمال ملاحظات نسبیتی و تقارن در فرمول هامیلتونی مکانیک کوانتومی میدان الکترومغناطیسی تولید کرد. دیراک به منظور حل برخی مشکلات در معادله نسبیتی خود، در سال 1930 مدلی از خلاء به عنوان دریای نامتناهی از ذرات با انرژی منفی ایجاد کرد که بعداً دریای دیراک نام گرفت. این امر باعث شد که او وجود یک پوزیترون، همتای پادماده الکترون را پیش بینی کند. این ذره در سال 1932 توسط کارل اندرسون کشف شد که پیشنهاد کرد الکترونهای استاندارد را نگترون نامیده و از الکترون به عنوان یک اصطلاح عمومی برای توصیف انواع بار مثبت و منفی استفاده کند.
در سال 1947، ویلیس لمب، با همکاری دانشجوی فارغ التحصیل رابرت رترفورد، دریافت که حالتهای کوانتومی خاصی از اتم هیدروژن، که باید انرژی یکسانی داشته باشند، نسبت به یکدیگر تغییر میکنند. این تفاوت تبدیل به تغییر بره نامیده شد. تقریباً در همان زمان، پلیکارپ کوش، با همکاری هنری ام. فولی، کشف کرد که گشتاور مغناطیسی الکترون کمی بزرگتر از پیشبینیشده توسط نظریه دیراک است. این تفاوت کوچک بعدها گشتاور دوقطبی مغناطیسی غیرعادی الکترون نامیده شد. این تفاوت بعدها توسط نظریه الکترودینامیک کوانتومی که توسط سین-ایتیرو توموناگا، جولیان شوینگر و ریچارد فاینمن در اواخر دهه 1940 توسعه یافت، توضیح داده شد.
شتاب دهنده های ذرات
با توسعه شتاب دهنده ذرات در نیمه اول قرن بیستم، فیزیکدانان شروع به کاوش عمیق تر در مورد خواص ذرات زیراتمی کردند. اولین تلاش موفقیت آمیز برای شتاب دادن به الکترون ها با استفاده از القای الکترومغناطیسی در سال 1942 توسط دونالد کرست انجام شد. بتاترون اولیه او به انرژی 2.3 مگا ولت رسید، در حالی که بتاترون های بعدی به 300 مگا ولت رسیدند. در سال 1947، تشعشع سینکروترون با سینکروترون الکترونی 70 مگا الکترونی در جنرال الکتریک کشف شد. این تابش ناشی از شتاب الکترون ها از طریق میدان مغناطیسی است که آنها نزدیک به سرعت نور حرکت می کنند.
با انرژی پرتو 1.5 GeV، اولین برخورد دهنده ذرات پرانرژی ADONE بود که در سال 1968 شروع به کار کرد. این دستگاه الکترونها و پوزیترونها را در جهتهای مخالف شتاب میداد و در مقایسه با برخورد با یک الکترون به یک هدف ساکن، انرژی برخورد آنها را به طور موثر دو برابر میکرد. برخورد دهنده بزرگ الکترون-پوزیترون (LEP) در سرن، که از سال 1989 تا 2000 عملیاتی بود، به انرژی برخورد 209 گیگا ولت دست یافت و اندازه گیری های مهمی را برای مدل استاندارد فیزیک ذرات انجام داد.
محصور شدن تک تک الکترون ها
اکنون میتوان الکترونهای منفرد را به راحتی در ترانزیستورهای CMOS بسیار کوچک (L = 20 نانومتر، W = 20 نانومتر) که در دمای برودتی در محدوده 269- درجه سانتیگراد (4 K) تا حدود -258 درجه سانتیگراد (15 کلوین) کار میکنند، محدود کرد. تابع موج الکترونی در یک شبکه نیمه هادی پخش می شود و به طور ناچیزی با الکترون های باند ظرفیت برهمکنش می کند، بنابراین می توان آن را در فرمالیسم تک ذره، با جایگزین کردن جرم آن با تانسور جرم موثر، درمان کرد.